变应原特异性免疫治疗
2014/11/13
西安交通大学医学院第二临床医院 710004
1、变应原特异性免疫治疗(SIT)的发展历程
IgE的发现、体外嗜碱粒细胞组胺释放试验和RAST、ELISA等方法的应用,为检测免疫疗法的各项参数和进一步探讨免疫疗法的机理提供了有利的条件。为了解决免疫疗法疗程过长、注射次数过多的缺点,又对免疫治疗的剂型和方式进行了改良,取得了明显的成功。
2、变应原特异性免疫治疗的机理
SIT可诱导机体产生特异性IgG(specific IgG ,sIgG)类循环抗体,后者能与再次进入体内的致敏原结合,阻止致敏原与肥大细胞或嗜碱粒细胞表面相应IgE结合,抑制肥大细胞或嗜碱粒细胞脱颗粒,从而阻断Ⅰ型超敏反应的发生。这类对抗原具有中和能力的sIgG称封闭抗体,目前认为主要为sIgG4[2]。上世纪80年代末,有人[3]对屋尘螨过敏的过敏性鼻炎和哮喘患者用屋尘螨浸液脱敏治疗了36个月。检测发现血清总IgE无明显变化,屋尘螨sIgE水平在脱敏治疗期间较治疗前普遍下降,屋尘螨sIgG4在治疗后6~24个月期间普遍增高。这说明螨脱敏治疗确能有效升高sIgG4和降低sIgE,从而阻断Ⅰ型超敏反应的发生。另外有人[4]研究了过敏性哮喘患者屋尘螨治疗前后IgE介导的和非IgE介导的嗜碱粒细胞组胺释放试验,结果发现与治疗前相比,SIT后4~9个月,患者嗜碱粒细胞被屋尘螨和抗人IgE刺激时释放组胺明显减少;对照组组胺释放量无明显变化。进一步证明了SIT和阻断IgE均可抑制肥大细胞或嗜碱粒细胞脱颗粒、炎症介质释放、阻断Ⅰ型超敏反应。
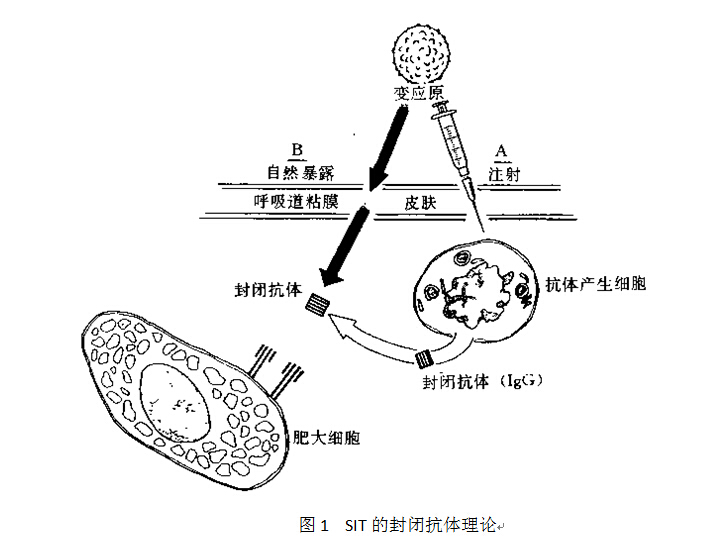
2)纠正Th1/Th2平衡失调
众所周知,变态反应疾病患者Th1/Th2失衡,表现为Th1细胞因子IL-12、IFN-γ等(主要由Th1细胞产生)减少,而促进体液免疫的细胞因子IL-4(主要由Th2细胞产生)明显增高。这种失衡的细胞因子微环境促使Th0向Th2分化。SIT可通过纠正上述细胞因子失衡来逆转Th1/Th2平衡失调。
(1)SIT对IL-4的影响 IL-4主要由Th2细胞产生、激活的肥大细胞及嗜碱粒细胞等也产生。它可促进B细胞活化并分泌IgE和IgG1;促进IgG向IgE类型转换;促进Th0细胞向Th2细胞分化。SIT可减少IL-4的产生。为了量化SIT在单个细胞水平上Th1/Th2细胞因子的效果,Majori等[5]检测了螨过敏哮喘患者外周血中CD4+和CD8+ T细胞胞内IFN-γ和IL-4水平。他们观察发现在增加脱敏原剂量阶段,外周血中CD4+ T细胞胞内IFN-γ/IL-4比例明显增加;经一年治疗后IFN-γ/IL-4增加更为显著。在CD8+T细胞胞内,三次检测IFN-γ/IL-4均无明显变化。因此,Majori等认为SIT可修正过敏哮喘患者CD4+ T细胞细胞因子的分泌,抑制IL-4诱导的Th0向Th2分化。
(2)SIT可促进IL-12和IFN-γ增高 IL-12是诱导Th0细胞向Th1细胞分化的关键细胞因子。它促进IFN-γ和IL-2合成,抑制Th2细胞合成IL-4;选择性抑制IL-4诱导的IgE合成。IL-12R由β1和β2链组成,β2链为信号转导链。Th1细胞可表达β2链,Th2细胞则不表达。所以,人们推想SIT若能使组织微环境IL-12增加,显然有利于Th0细胞向Th1细胞分化和Th1细胞发挥其效应。为此,在过敏性哮喘患者成功地进行了快速免疫治疗后,Tazaki等[6]采其外周血单个核细胞(PBMC),以尘螨木薯粉刺激。他们发现经尘螨木薯粉变应原刺激后,快速免疫治疗组患者CD4+T细胞产生的IL-12和IFN-γ较对照组患者显著增高,而IL-4显著下降。且无论在IL-12和IFN-γ刺激CD4+T细胞前或后,快速免疫治疗组患者CD4+T细胞表达的IL-12Rβ2链也较对照组显著增高。这就从实验上证实了SIT可增加CD4+T细胞表达IL-12和IL-12Rβ2,从而诱导Th0细胞向Th1细胞分化。
3)调节性T细胞(CD4+ CD25+ Tr细胞)的调节作用
CD4+ CD25+ Tr可抑制CD4+ 或CD8+ T细胞活化与增殖,在免疫应答中发挥负性调节作用。CD4+ CD25+ Tr细胞[7]分泌IL-10和TGF-β,完全抑制抗原特异性T效应细胞增殖,抑制Th1和Th2型细胞因子分泌,抑制IgE产生的同时分别增加IgG4和IgA的产生;另外CD4+ CD25+ Tr细胞还直接抑制过敏性炎症效应细胞:如肥大细胞和嗜碱粒细胞。有临床实验[8]证明,SIT能有效提高过敏性哮喘患者血中CD4+ CD25+ Tr细胞计数和IL-10水平,从而发挥调节机体免疫的功能。CD4+ CD25+ Tr细胞的作用机制是:直接作用:①化学趋化因子配体CCL1/I-309能趋化CD4+ CD25+ Tr细胞迁移到免疫应答局部,通过细胞表面抑制性受体CTLA-4和转化生长因子-β(TGF-β)的作用,抑制靶细胞表面IL-2Rα链表达,从而抑制靶细胞增殖[9];②CD4+ CD25+ Tr细胞可分泌IL-10和TGF-β,继而发挥免疫抑制效应。间接作用:CD4+ CD25+ Tr细胞能通过抑制抗原递呈细胞(APC)的功能而间接抑制CD4+ 或CD8+ T细胞活化与增殖,其机制为:CD4+ CD25+ Tr细胞可下调APC膜表面共同刺激分子CD80/CD86(即B7分子,它与T细胞表面的CD28结合,提供T细胞活化的第二信号)的表达,抑制APC对抗原的提呈作用,使T细胞因缺乏共同刺激信号而克隆失能。
4)诱导外周耐受
IL-10诱导的抗原特异性T细胞失能可以形成外周耐受。Cezmi等[10]发现蜂毒液脱敏治疗初期,抗原特异性T细胞自分泌的IL-10增加,随着治疗的进展,B细胞和单核细胞也产生IL-10,增加的IL-10不仅可使抗原特异性T细胞失能,还可抑制sIgE和促进sIgG4合成。在IL-2或IL-15存在的情况下对失能的T细胞用抗原刺激,可完全恢复其分泌IFN-γ的能力。因此,Cezmi等推测IL-10诱导的外周T细胞失能以及后来组织微环境的细胞因子对失能的T细胞再活化是SIT的两个关键步骤。但现已证实,Fas/FasL途径介导的细胞死亡(activation-induced cell death, AICD)是维持外周T细胞耐受的主要机制。即T细胞通过自分泌Fas/FasL导致自身凋亡[11]。静止的T细胞活化通常会导致它们增殖和分化成效应T细胞,并清除活化它们的抗原,如抗原密度过大就可诱导效应T细胞清除,在内源性IFN-γ协同下,这种清除主要通过Fas/FasL途径,而不依赖于穿孔素和颗粒酶[12]。Grzegorczyk等[13]研究了过敏患者和非过敏患者PBMCs自发或经Der p I抗原致敏后凋亡情况。结果发现过敏患者单个核细胞和淋巴细胞的凋亡指数明显高于非过敏患者组,而血清可溶性Fas水平正好相反。这个实验说明SIT诱导的PBMC凋亡与Fas/FasL介导的AICD明显相关。Zhang等[14]进一步研究发现要诱导全身耐受的T细胞,需要APC表达FasL,抗原特异性T细胞表达Fas。通过APC表达FasL、外周抗原特异性T细胞快速克隆删除,诱导耐受即可形成。
3、变应原特异性免疫治疗的方法
(1)皮下免疫治疗
从20世纪初期开始近100多年时间里,皮下注射是脱敏治疗唯一的给药途径。其疗效已经得到肯定,目前已广泛应用于临床。但由于免疫治疗通常需要坚持2至3年或更长时间的疗程,而且皮下注射必须到医院进行,带来的不便和痛苦使患者的依从性下降,而且临床副作用较多。
(2)局部免疫治疗
目前舌下途径免疫治疗(sublingual immunotherapy,SLIT)在欧洲正被许多研究所推荐。大量临床资料表明,应用禾草、螨、桦树、墙草等的花粉变应原用于SLIT的有效率为20%~50%,接近于皮下途径免疫治疗。最常见的不良反应为口腔-舌下刺痒感,大多轻且可自我缓解。一项针对儿童为期十年的前瞻性研究也证实,舌下免疫治疗同样具有长效作用且停止治疗后作用可维持4、5年[15]。但到目前为止,具有双盲、安慰剂对照研究及长期疗效观察特征的局部特异免疫治疗试验尚不多,有待进一步大规模的双盲对照研究来客观评价。鼻部免疫治疗经证实是有效的,但作用只是局限在过敏性鼻炎[16]。口服免疫治疗和支气管免疫治疗,目前缺乏足够支持临床使用的有效性和安全性证据,这两种方法已经弃用。
有关SLIT和皮下免疫治疗的对比性研究很少。Khinchi等[17]进行了一个随机、双盲对照研究。经过2年治疗后,2组患者均有理想的症状缓解。皮下治疗组出现5例次全身反应,其中2例用肾上腺素治疗。SLIT组无一例全身反应发生,但大多数出现局部刺痒和轻微的口腔、咽喉水肿。
2)给药剂量
(1)皮下注射的剂量
免疫治疗的剂量,关系到疗效和安全性。低剂量免疫治疗是无效的,而剂量过高又可能引起不能接受的严重全身反应。因此,理想的剂量被定义为,在大多数患者中能诱导产生临床效果,而不引起难以接受的不良反应的变应原疫苗剂量。对已经标准化的大多数变应原疫苗而言,其中主要变应原的最适剂量是5~20μg。
(2)舌下途径免疫治疗的剂量
舌下途径合适的剂量尚未清楚,在相关文献中,有效剂量范围为皮下途径免疫治疗剂量的3~5倍到375倍不等。
好几种供舌下使用的商业变应原疫苗即将准备在欧洲投入临床应用。但在美国这样的疫苗尚未被认可。剂量、疗程和治疗后免疫学变化等许多问题尚待解决。
(3)疗程
关于SIT疗程,目前认为仍是一种不限期的治疗,就象吸入激素一样,还没有一个较好的停药指标,一般在治疗起效后至少维持2~3年。
3)适应症
WHO和欧洲变态反应与临床免疫学会先后提出了关于变态反应疾病患者采用SIT治疗的建议:
(1)过敏原所致者;
(2)青少年效果比老年人好;
(3)SIT注射必须在无症状期进行;
(4)患者第1秒用力呼气容积(FEV1)在70%预计值以上;
(5)对动物过敏又不愿放弃饲养者;
(6)变应原制备必须标准化。
4、变应原特异性免疫治疗的疗效
1998年,登载于《变态反应(Allergy)》[20]增刊和《变态反应和临床免疫学杂志(Journal of A1lergy and Clinical Immunology)》[22]的WHO的指导性文章对SIT作了总结,肯定了SIT的疗效,认为正确的SIT应与其他所有形式的治疗一起应用,最后达到消除症状的目的。
5、变应原特异性免疫治疗的安全性及存在问题
SIT主要存在的危险是全身性不良反应。Lockey等(1987)首次报道了1958~1984年间北美地区发生致死性不良反应病例,结果显示有24例死于免疫脱敏注射,6例死于皮肤试验。6年后Reid等(1993)报道了1985~1989年期间15例因免疫治疗和2例因皮肤试验发生的死亡事件。以上2组研究中出现致死性不良反应的概率分别为1/280万注射次和1/200万注射次。Bernstein等(2004)总结1990~2001这12年间,北美地区共有41例死亡病例。出现致死性不良反应的概率为1/254万注射次,与以上2组研究结果相近。与以往研究中致死性不良反应大多出现剂量累加阶段形成鲜明对比的是,本组数据绝大多数致死不良反应出现在维持剂量治疗阶段。这也可能是由于临床操作的进一步规范减少了剂量错误,也是剂量累加阶段不良反应减少的缘故。
6、变应原特异性免疫治疗的前景
变态反应病特异性免疫治疗的应用历史几乎与变态反应学本身的历史一样长,而且对变态反应病来说,疗效肯定。但是,脱敏治疗的发展远非一帆风顺。由于发生了一些因免疫注射引起的死亡病例,使一些欧洲国家曾明文规定禁止再用免疫疗法治疗变态反应病。这些决定一度造成了极大的思想紊乱。但是即使在这些国家,禁令并未严格执行,主要是出于脱敏治疗独特的疗效不是其他治疗方法所能代替的;而大宗病例的统计证明与别的疗法相比,免疫疗法的安全系数还是比较高的;少数严重反应的发生主要是由于操作不规范,不能归因于方法本身。这样,禁令也就自然而然地解除了。特别是近年WHO以“立场声明”的形式对此种疗法作了肯定,并提出变态反应病有进行特异性免疫疗法适应证的,应尽早应用,而不是等其他疗法治疗无效时才用。WHO的这篇“立场声明”要求在免疫治疗开始之前,即使是已经病史和皮肤试验确定了诊断的,也要测定其血清中特异性IgE的水平。目前,在国内外已有多种不同IgE检测方法可供应用。
复合变应原不仅在变态反应病的诊断方面,而且在治疗方面都展现了广阔的前景。与变应原提取物相反,重组变应原产品纯度高,制剂稳定,具有单一变应原的特点,可以根据每一患者的需要,进行特异性诊断和治疗。由于各种变应原之间高度的顺序相应性,只需要几种重组变应原,进行不多的注射,就可完成诊断和治疗。还可以通过低聚化,制备“低变应原性”的重组变应原,这种制剂引起过敏反应的可能性极小,因此临床应用将更为安全。
参考文献
1.Norman PS.Immunotherapy:past and present.J Allergy Clin Immunol,1998,102(1):1-10.
2.Van der Zee S,Aalberse RC.IgG4 and hyposensitization.N Engl Reg Allergy Proc, 1987, 8(6):389-391
3.Ruiz de Leon Loriga J,Lluch Perez M,Valero Santiago A,et al.Evaluation of immune parameters (including specific IgG4) during immunotherapy.Allergol Immunopathol (Madr),1989,17 (3):119-127.
4.Shim JY,Kim BS,Cho SH,et al.Allergen-specific conventional immunotherapy decreases immunoglobulin E-mediated basophil histamine releasability.Clin Exp Allergy,2003, 33(1):52-57.
5.Majori M, Caminati A, Corradi M. T-cell cytokine pattern at three time points during specific immunotherapy for mite-sensitive asthma.Clin Exp Allergy,2000,30(3):341-347.
6.Tazaki T, Minoguchi K, Yokoe T, et al. Allergen rush immunotherapy increases interleukin (IL)-12 production and IL-12 receptor beta2 chain expression in patients with allergic asthma.Cell Immunol,2004,228(1):20-26.
7.Akdis CA, Blaser K, Akdis M. Genes of tolerance. Allergy, 2004,59(9):897-913.
8.Francis JN, Till SJ, Durham SR. Induction of IL-10 + CD4+ CD25+T cells by grass pollen immunotherapy.J Allergy Clin Immunol,2003,111(6):1255-1261.
9.Francesco Annunziato,Lorenzo Cosmi,Francesco Liotta,et al. Phenotype, Localization, and Mechanism of Suppression of CD4+CD25+Human Thymocytes.J Exp Med,2002, 196(3):379-387.
10.Cezmi A.AKDIS and KURT BLASER.IL-10-induced anergy in peripheral T cell and reactivation by microenvironmental cytokines:two key steps in specific immunotherapy. FASEB J,1999,13(9): 603-609.
11.Dhein J,Walczak H,Baumler C,et al.Autocrine T-cell suicide mediated by APO-1/ (Fas/CD95). Nature, 1995, 373 (6513):438-441.
12.Sobek V,Balkow S,Korner H,et al.Antigen-induced cell death of T effector cells in vitro proceeds via the Fas pathway,requires endogenous interferon-gamma and is independent of perforin and granzymes.Eur J Immunol,2002,32(9):2490-2499.
13.Grzegorczyk J,Kowalski ML,Pilat A,et al.Increased apoptosis of peripheral blood mononuclear cells in patients with perennial allergic asthma/rhinitis:relation to serum markers of apoptosis.Mediators Inflamm,2002,11(4):225-233.
14.Zhang HG, Su X, Liu D, et al. Induction of specific T cell tolerance by Fas ligand- expressing antigen-presenting cells. JImmunol,1999,162(3):1423-1430.
15.Di-Rienzo V, Marcucci F, Puccinelli P, et al. Long-lasting effect of Sublingual immunotherapy in children with asthma due to house dust mite:a ten year prospective study. Clin Exp Allergy, 2003; 33(2): 206~210
16.Incorvaia C, Frati F, Puccinelli P,et al. Effects of sublingual immunotherapy on allergic inflammation . Inflamm Allergy Drug Targets. 2008;7(3):167-72
17.Khinchi M S, Poulsen L K, Carat F, et al. Clinical efficacy of sublingual and subcutaneous birch pollen allergen-specific immunotherapy: a randomized, placebocontrolled, double-blind, double-dummy study. Allergy, 2004, 59: 45-53
18.Durham S R, Walker S M, Varga E M, et al. Long-term clinical efficacy of grass-pollen immunotherapy. N Engl J Med, 1999, 341: 468-475
19.No auther. Allergen immunotherapy: therapeutic vaccines for allergic diseases. Geneva: January 27-29 1997. Allergy,1998,53(44 Suppl):1-42.
20.Bousquet J, Lockey R, Malling H J. Allergen immunotherapy: therapeutic vaccines for allergic diseases. A WHO position paper. J Allergy Clin Immunol,1998,102(4pt 1):558-562
21.Moreno C, Cuesta-Herranz J Fernandez-Tavora L, et al. Immunotherapy safety: a prospective multi-centric monitoring study of biologically standardized therapeutic vaccines for allergic diseases. Clin-Exp-Allergy, 2004; 34(4): 527~31
22.Bousquet J, Van Cauwenberge P, Khaltaev N, et al. Allergic rhinitis and its impact on asthma. J Allergy Clin Immunol,2001,108:147-334
上一篇:
昆虫性变态反应
下一篇:
IL-17对iNOS/NO信号通路的调控在哮喘气道重塑中的作用









