FENO检测在支气管哮喘中的应用——FENO检测在哮喘监测中的价值(下)
2010/12/06
龚颖 叶伶 金美玲
上海复旦大学附属中山医院呼吸科 200032
FENO水平与气道炎症的严重程度存在相关性。研究表明,急性重症哮喘患者的FENO水平较稳定期增高;近期有临床表现的患儿的FENO水平高于无症状表现的患者[1]。
此外,某些因素会导致哮喘患者FENO水平的变化。例如在过敏季节或接触过敏原后FENO水平会升高,而减少过敏原接触后FENO水平则会下降。过敏性鼻炎合并哮喘的患者其FENO水平高于单纯哮喘患者。仅单纯过敏性鼻炎而未合并哮喘的患者其FENO水平增高,就预示着其有发展为哮喘的危险性。有鉴于此,有必要建立患者的个人基线值以利于长期监测。
最近研究表明,FENO水平明显与哮喘控制的指标,如症状、呼吸困难分数、日常是否需要使用紧急用药、气道阻塞的可逆性等相关,但与哮喘严重程度的指标,如呼吸衰竭史、健康护理和不可逆的气道阻塞无关[20]。这提示FENO水平最有可能用于评估哮喘的控制程度,而不是用于哮喘严重程度的评估。但Delgado- Corcoran等的研究发现,FENO水平在轻度、中度和重度哮喘中具有显著差别,随着哮喘严重程度的增加,FENO水平相应升高[21]。
1. FENO对激素治疗的反应性
激素在体内外可以抑制iNOS的诱导作用,故而在使用激素治疗后会出现FENO水平下降,即使是吸入低剂量的激素也能迅速而显著地抑制FENO水平。当使用激素雾化治疗后6小时或予以吸入型激素(inhaled corticosteroids, ICS)治疗后2~3天,FENO水平就会出现明显的降低,2~4周时达最大效果[22]。进一步研究表明,FENO水平与激素治疗的顺应性之间存在很好的相关性(r=0.586,p=0.0003)[23](见图5)。且有研究显示,在使用激素治疗后FENO水平的下降早于患者的症状、气道阻塞程度和气道高反应性的改善[24](见图6)。这表明FENO对于激素的治疗极为敏感。因此,在哮喘治疗中FENO可作为激素治疗疗效评估的衡量指标,有助于监测哮喘患者的病情变化。而与之相比,尽管诱导痰中嗜酸性粒细胞的增加亦是预示哮喘病情恶化的很好指标,但其变化过于缓慢。

图5 FENO与吸入性类固醇顺应性之间的关系。引自参考文献23。
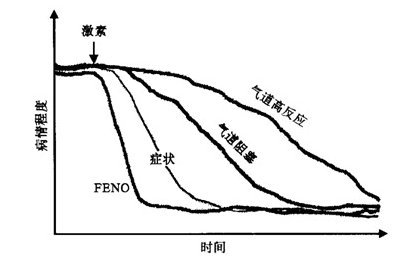

图6 FENO及其他哮喘指标对激素治疗反应的示意图。引自参考文献24。
(图中可见FENO是反应最快的指标)
2. FENO在哮喘激素治疗中的指导作用
哮喘的治疗目标已由原先的解除支气管痉挛转变为目前的控制气道炎症,故而消除或控制气道炎症是治疗哮喘和防止其复发的关键。临床上常用于反映哮喘严重程度,指导其治疗的指标包括:哮喘症状评分、吸入β受体激动剂的次数及肺功能等。这些指标不能直接地评价气道炎症情况,与支气管肺组织活检中的嗜酸性粒细胞性炎症反应无相关性。有研究提示,通过监测气道反应性、诱导痰嗜酸性粒细胞计数来调整激素治疗,哮喘急性发作次数及急诊就诊率会明显降低。因而建议在哮喘规范化的治疗和管理中加用反映气道炎症的指标。但是诱导痰嗜酸性粒细胞分析受到技术及患者接受程度的限制使其难以被广泛应用于临床实践。
作为气道炎症指标的FENO检测起来简单、快速、安全,且对激素治疗存在高度敏感性。此外,当哮喘病情恶化时FENO常在其他指标(诸如肺功能,嗜酸性粒细胞等)发生明显改变前就出现增高,因此其可作为哮喘失控的早期警告指标。研究证实,在激素减量治疗后2周和4周,哮喘未控制患者的FENO水平就会分别增高40%和100%,且在增高的同时会伴有肺功能的恶化和症状的出现。对于急性发作的儿童,当使用激素治疗5天时,FENO水平下降65%,且临床症状和FEV1都会得到改善[1]。Zietkowski等的研究显示,急性恶化的哮喘患者经过激素治疗病情会好转,同时FENO水平很快呈相应的下降,且其降低远远早于肺功能的改善[25]。Jones等的研究则以停止ICS后哮喘失控的轻-中度患者为研究对象,并随机分为安慰剂组和布地耐德50、100、200、500 μg/d治疗组,观察八周。在实验开始及终止时行高渗盐水激发试验及诱导痰嗜酸性粒细胞计数,前四周每周及实验结束时随诊监测FENO和肺功能。结果显示实验结束时肺功能及诱导痰嗜酸性粒细胞计数的变化,仅在500 μg/d治疗组同100 μg/d治疗组及安慰剂组间存在统计学差异,其它不同治疗组间无明显差异;激发试验在各组治疗前后无明显差异;从实验开始至结束期间,各组FENO的变化同吸入激素的剂量存在明显的剂量反应关系[26]。有鉴于此,可以将FENO作为评价激素抗炎治疗的一个有效指标。通过监测FENO这一反映气道炎症指标的变化来指导哮喘的治疗,从而改善哮喘的控制情况。
在随访过程中,首先要建立患者FENO的稳定基线值,且建议同时测定患者的FENO与肺功能,共同分析。如果FENO水平显著下降,并伴有肺功能改善,提示治疗成功。如果FENO水平下降,而治疗失败,提示临床医师对该患者治疗不充分或治疗不对症。如果FENO水平上升超过稳定基线的20%,提示患者近来病情加重或将出现病情加重,或对治疗的依从性不好。患者临床症状恶化但FENO及肺功能无变化,则应注意有可能存在有其他疾病。那些FENO基础水平较高且治疗后仍然较高的患者,可能需要较高的激素剂量或患者可能存在激素抵抗,需要其他类型的抗炎治疗。与其相反,那些FENO水平正常,且未对抗炎治疗产生应答的患者,他们的嗜酸性粒细胞感染可能很弱甚至根本没有,因此,持续性的抗炎治疗对其可能并不适宜。
但需要注意的是,尽管激素可以降低FENO水平,但其并未受到完全抑制。Stirling等发现,那些病情难以控制的哮喘患者(例如需要高剂量吸入性或口服激素)其FENO水平要低于未使用激素的哮喘患者,但明显高于正常对照组[27]。同样的,Artlich等发现,近期出现过支气管阻塞症状的儿童其FENO水平较高,即使在对其进行激素治疗后亦是如此[28]。
3. FENO在指导ICS减量方面的价值
目前哮喘的治疗方案主张以肺功能和症状控制评分作为调整抗炎药物剂量的方法。最近,许多研究机构提出通过平衡炎症来计算最佳药量这一新观点,即如果炎症状态超过一定程度,则患者ICS的剂量应增加;而当炎症状态低于某一水平时,则应减少ICS剂量。FENO水平的变化与ICS呈剂量依赖性,所以可以通过监测FENO来帮助确定吸入激素剂量,从而合理使用药品。
有研究表明,以FENO来监测哮喘的治疗可以减少激素的使用量。Smith等在一项研究中把97例已经规范使用ICS治疗的哮喘患者随机分为试验组和对照组,其中试验组依据检测的FENO调整用药剂量,对照组按照GINA推荐的标准(哮喘症状分级、支气管扩张剂的使用情况及肺功能的结果)调整激素用量,随访12个月。研究结果显示,试验组每日ICS的平均剂量为370μg/d,对照组为641μg/d,两者间有显著统计学差异;而且试验组一年内哮喘急性发作率为0.49/人年,低于对照组的0.90/人年;进一步分析发现前5个月两组哮喘急性发作例数间无明显差异,后7个月FENO组哮喘发作无明显增加,而对照组哮喘急性发作呈明显上升趋势[29]。该项研究表明,在保证哮喘控制的前提下,通过监测FENO来指导ICS剂量的调整,其最终吸入激素量明显低于在使用传统的评价标准下的激素用量。这一研究结果令人鼓舞。
目前世界范围内有多个临床中心正在对FENO是否可以作为指导ICS治疗剂量最佳化的炎性指标进行研究。
4. FENO在监测无症状哮喘患者中的价值
哮喘患者经激素抗炎治疗后其症状可以得到控制,但其气道炎症始终存在。FENO可以用于监测无症状哮喘患者的气道炎症。de Kluijver等把无症状哮喘患者随机分为布地耐德400μg/d 吸入组及安慰剂对照组,两组每天均接受小剂量致敏原,观察12d后发现两组间的FEV1、日间症状评分及最大呼气流速无显著差异,但激素治疗组的FENO及诱导痰嗜酸性粒细胞明显低于对照组[30]。
5. FENO在预测哮喘急性发作中的价值
预防哮喘急性发作是哮喘管理中最为重要的一个目标,在临床症状和呼吸道阻塞出现之前能够及时预测病情恶化具有非同寻常的意义。FENO可作为预测哮喘急性发作的一个指标。挪威的一项包括800名青少年的研究结果表明,结合气道反应性测定,FENO对于哮喘监测具有预测价值[1]。Pijnenburg等在一项队列研究中发现,哮喘患者停用激素治疗4周后以FENO来预测哮喘复发,其敏感性可达73%、特异性可达93%[31]。Crater等人发现,急性及稳定期哮喘的成年患者其FENO水平与外周血嗜酸性粒细胞增多有着极为显著的相关性。当FENO大于10ppb而嗜酸性粒细胞增多大于200细胞/微升时,有90%的准确性预测其为急性呼吸道阻塞[32]。Jatakanon等和Jones等相继以ICS逐步减量的成年哮喘患者为研究对象,发现FENO同诱导痰嗜酸性粒细胞一样,是较肺功能能够更好地预测哮喘急性发作的指标[18, 33]。Zacharasiewicz等的研究显示,以25 ppb(流量为50 mL/s)作为评判点时,FENO用于病情恶化的阳性预测率为60%,阴性预测率为90%。进而使用纵向研究数据,FENO超过25 ppb时,其预测病情恶化的敏感度为73%[34]。
结论
FENO水平可以反映气道的炎症及高反应性。与其他诊断指标相比,FENO同样具有很高的敏感性和特异性,且具有无创、简便、迅速、安全等优势。在哮喘的规范化治疗和管理中,尤其是在指导ICS的使用和监测病情变化方面,FENO具有重要意义。因此可以相信,FENO检测将在哮喘的诊断和监测中发挥更为重要的作用。
参考文献
1 Chitra Dinakar. Exhaled nitric oxide in the clinical management of asthma. Current Allergy and Asthma Reports, 2004, 4: 454–459.
2 American Thoracic Society/European Respiratory Society. ATS/ERS recommendations for standardized procedures for the online and offline measurements of exhaled lower respiratory nitric oxide and nasal nitric oxide. Am J Respir Crit Care Med, 2005, 171: 912-930.
3 Kharitonov SA, Gonio F, Kelly C, et al. Reproducibility of exhaled nitric oxide measurements in healthy and asthmatic adults and children. Eur Respir J, 2003, 21: 433-438.
4 Aerocrine, Solna, Sweden. Exhaled nitric oxide: a noninvasive marker for inflammation. 2007.
6 Alving K, Weitzberg E, Lundberg JM. Increased amount of nitric oxide in exhaled air of asthmatics. Eur Respir J, 1993, 6: 1368-1370.
7 Moody A, Fergusson W, Wells A, et al. Increased nitric oxide production in the respiratory tract in asymptomatic Pacific Islanders: an association with skin prick reactivity to house dust mite. Allergy Clin Immunol, 2000, 105(5): 895-899.
8 Fabbri LM, Romagnoli M, Corbetta L, et al. Differences in airway inflammation in patients with fixed airflow obstruction due to asthma or chronic obstructive pulmonary disease. Am J Respir Crit Care Med, 2003, 167: 418-424.
9 Dupont LJ, Demedts MG, Verleden GM. Prospective evaluation of the validity of exhaled nitric oxide for the diagnosis of asthma. Chest, 2003, 123: 751-756.
10 Narang I, Ersu R, Wilson NM, et al. Nitric oxide in chronic airway inflammation in children: diagnostic use and pathophysiological significance. Thorax, 2002, 57: 586-589.
12 Smith AD, Cowan JO, Filsell S, et al. Diagnosing asthma: comparisons between exhaled nitric oxide measurements and conventional tests. Am J Respir Crit Care Med, 2004, 169: 473-478.
13 Aerocrine, Solna, Sweden. NO in clinical practice. June, 2006.
14 Warke TJ, Fitch PS, Brown V, et al. Exhaled nitric oxide correlates with airway eosinophils in childhood asthma. Thorax, 2002, 57: 383-387.
15 Malmberg LP, Turpeinen H, Rytila P, et al. Determinants of increased exhaled nitric oxide in patients with suspected asthma. Allergy, 2005, 60: 464-468.
17 Al-Ali MK, Howarth PH. Exhaled nitric oxide levels in exacerbations of asthma, chronic obstructive pulmonary disease and pneumonia. Saudi Med J, 2001, 22: 249-253.
18 Jatakanon A, Lim S, Kharitonov SA, et al. Correlation between exhaled nitric oxide, sputum eosinophils, and methacholine responsiveness in patients with mild asthma. Thorax, 1998, 53: 91-95.
19 Silvestri M, Spallarossa D, Frangova Yourukova V, et al. Orally exhaled nitric oxide levels are related to the degree of blood eosinophilia in atopic children with mild-intermittent asthma. Eur Respir J, 1999, 13: 321-326.
20 Sippel JM, Holden WE, Tilles SA, et al. Exhaled nitric oxide levels correlate with measures of disease control in asthma. J Allergy Clin Immunol, 2000, 106: 645-650.
21 Delgado-Corcoran C, Kissoon N, Murphy SP, et al. Exhaled nitric oxide reflects asthma severity and asthma control. Pediatr Crit Care Med, 2004, 5: 48-52.
22 Lim S, Jatakanon A, John M, et al. Effect of inhaled budesonide on lung function and airway inflammation. Am J Respir Crit Care Med, 1999, 159: 22-30.
23 Beck-Ripp J, Griese M, Arenz S, et al. Changes of exhaled nitric oxide during steroid treatment of childhood asthma. Eur Respir J, 2002, 19: 1015-1019.
24 Bates AC. Exhaled netric oxide in asthma: from bench to bedside. J Allergy Clin Immunol, 2003, 111: 256-262.
25 Zietkowski Z, Bodzenta-Lukaszyk A. Exhaled nitric oxide(NO) in asthma patients with acute exacerbation. Pol Merkuriusz Lek, 2004, 16: 111-114.
26 Jones SL, Herbison P, Cowan JO, et al. Exhaled NO and assessment of anti-inflammatory effects of inhaled steroid: dose-response relationship. Eur Respir J, 2002, 20: 601-608.
27 Stirling RG, Kharitonov SA, Campbell D, et al. Increase in exhaled nitric oxide levels in patients with difficult asthma and correlation with symptoms and disease severity despite treatment with oral and inhaled corticosteroids. Asthma and Allergy Group. Thorax, 1998, 53: 1030-1034.
28 Artlich A, Busch T, Lewandowski K, et al. Childhood asthma: exhaled nitric oxide in relation to clinical symptoms. Eur Respir J, 1999, 13: 1396-1401.
29 Smith AD, Cowan JO, Brassett KP, et al. Use of exhaled nitric oxide measurements to guide treatment in chronic asthma. N Engl J Med, 2005, 352: 2163-2173.
30 de Kluijver J, Evertse CE, Schrumpf JA, et a1. Asymptomatic worsening of airway inflammation during low-dose allergen exposure in asthma: protection by inhaled steroids. Am J Respir Crit Care Med, 2002, l66: 294-300.
31 Pijnenburg MW, Hofhuis W, Hop WC, et al. Exhaled nitric oxide predicts asthma relapse in children with clinical asthma remission. Thorax, 2005, 60: 215-218.
32 Crater SE, Peters EJ, Martin ML, et al. Expired nitric oxide and airway obstruction in asthma patients with an acute exacerbation. Am J Respir Crit Care Med, 1999, 159: 806-811.
33 Jones SL, Kittelson J, Cowan JO, et al. The predictive value of exhaled nitric oxide measurements in assessing changes in asthma control. Am J Respir Crit Care Med, 2001, 164: 738-743.
34 Zacharasiewicz A, Wilson N, Lex C, et al. Clinical use of noninvasive measurements of airway inflammation in steroid reduction in children. Am J Respir Crit Care Med, 2005, 171: 1077.









