吴昌归
第四军医大学西京医院呼吸科 (西安 710032)
前言
哮喘是一种慢性气道炎症,以气道高反应性为特征,伴有可逆的呼气气流受限。急性重症哮喘是指发作时危及生命的哮喘、并且对常规治疗反应较差、需要住院治疗的哮喘。严重发作时可出现以下症状:辅助呼吸肌运动、奇脉(吸气时收缩压较呼气时降低>25mmHg)、心率>110次/分、呼吸频率>25~30次/分,语言断续或不能说话,呼气峰流速(PEFR)或第1秒最大呼气量(FEV1)<50%预测值, 动脉血氧饱和度< 91~92%。2000年美国胸科医师协会对于重症哮喘的定义见表1。
大部分死于急性重症哮喘的患者因不能及时进行紧急医疗救所致,多发生于家中或者在送往医院的途中。实际上,及时实施紧急救治就意味着更高的生存率。不能正确认识某些未得到适当治疗的致命性哮喘发作的严重性,可能会导致不良后果的发生。需要重点强调的是:症状和临床表现可能与气道阻塞的严重性相关不大。尽管人们很担心急性重症哮喘的死亡率会不断增高,但是大部分的患者依然可以从其中死里逃生。全美的多项研究报道了共在15300位急性重症哮喘发作时及时送达医院的患者中,有67例死亡(死亡率0.43%)。在普通病房,该类患者的死亡率为0.11%;监护病房,该类患者的死亡率为2.4%,气管插管患者的死亡率较高。而在欧洲的一项研究发现,院内死亡率为16.5%,出院后1年死亡率为10.1%,两年死亡率22.6%;该项研究患者的预后如此之差,不得而知,但是,这些数据明确指出:急性重症哮喘需要持续的长期监测以预防/控制复发。
表1 2000年美国胸科医师协会对于重症哮喘的定义
|
主要标准:
· 持续或者基本持续应用(每年≥50%的天数)口服皮质激素治疗;
· 需要高剂量的吸入性皮质激素治疗;
次要标准:
· 每天需要额外应用控制用药(如LABAs,茶碱,或者白三烯拮抗剂);
· 哮喘症状需要或者基本需要每天一次的短效β2受体激动剂治疗;
· 持续性的气道阻塞(FEV1<80%预测值,PEF日夜变异率>20%);
· 每年至少有一次因哮喘而去急诊;
· 每年有三次以上口服激素冲击治疗;
· 口服或者注射用激素减量25%时,症状迅速恶化;
· 有致命性哮喘发作史;
满足至少一个主要条件+两个次要条件,排除其他哮喘恶化因素,患者依从性好。 |
发病机制
不久前,人们认为所有的哮喘都是相似的,除了其严重程度不同和由此引起的控制需要应用皮质激素和β2-受体激动剂的的剂量、给药途径、频率不同外。但是,随着哮喘亚型的确定,这个观点受到了挑战。过去20年的研究已经证实过敏途径是哮喘发作的基础,其中一种T细胞亚集(Th2细胞)起到了重要作用,该细胞可合成和释放多种细胞因子和趋化因子,调节IgE和肥大细胞、嗜碱性粒细胞、嗜酸性粒细胞的成熟、募集和活化。在中-重度哮喘中导致气道功能异常的过敏途径一般都对皮质激素比较敏感。
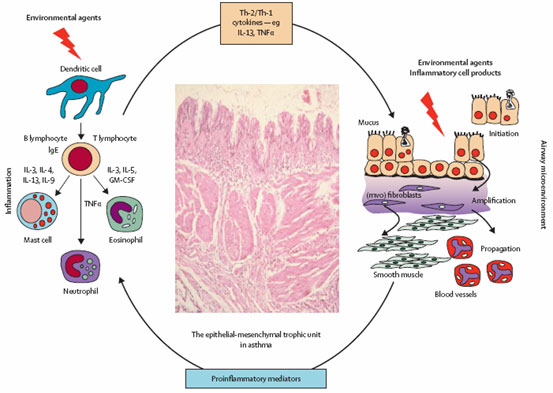
但是,在有的重症哮喘中,中性粒细胞参与了炎症反应,并有组织损伤和气道重建的证据(如图1)。该类哮喘的气道表现出持续性的上皮细胞破坏和修复的慢性损伤的特点。因为损伤的刺激而动员间质细胞参与到损伤修复过程,其释放多种生长因子包括上皮生长因子(EGF)、转化生长因子α (TGFα)、双向调节蛋白、肝素结合样生长因子(HB-EGF)、角质化细胞生长因子(KGF)、成纤维细胞生长因子(FGFs)、胰岛素样生长因子(IGFs)、血管内皮生长因子(VEGFs)和转化生长因子β(TGFβ)等。这些因子共同促进了气道重建和新的血管形成。气道上皮表现出损伤的特征,过度表达EGF受体,抗氧化的防御功能减弱。
上皮功能的紊乱和间质细胞的活化预示着上皮—间质营养单元(epithelial-mesenchymal trophic unit ,EMTU)在发病过程中起到重要作用,EMTU与肺的发育、疾病的慢性化和气道重建有关。该过程包括逐渐增多的细胞外基质在基膜的上皮下网状层不断沉积,弹力纤维丝断裂,1、3、5、6型胶原在气道全层(包括平滑肌层)的沉积,从而导致气道增厚、僵硬。气道增厚僵硬与气道高反应性的关系依然不清楚,似乎平滑肌的改变与此关系密切。在重症哮喘中,平滑肌束增多增大,向上影响大的气道(包括支气管)向下影响呼吸性细支气管和肺泡管。在这个新的微环境中,募集、扣留并活化选择性的炎症细胞(如单核细胞、肥大细胞、中性粒细胞)的能力发生了改变。所以,尽管使用了大剂量的吸入和口服皮质激素,肥大细胞却不减少甚至会增加,尤其是在气道平滑肌束内或者接近平滑肌处,这些地方有大量的肿瘤坏死因子α。在使用高剂量吸入皮质激素的重症哮喘患者中,其支气管肺泡灌洗液中的肿瘤坏死因子α水平增高,组织活检其mRNA水平也较高。肥大细胞是IL—13的一个重要来源,IL—13可能是潜在的导致炎症反应和气道重建的一个重要细胞因子。导致EMTU处于活化状态的因素有:过敏原——尤其是那些具有生物活性的过敏原(如来自于尘螨、真菌和蟑螂的过敏原)、与哮喘恶化相关的病毒反复感染、空气污染(如室内外环境中的烟草烟雾)。
图1 哮喘患者气道上皮-间质营养单元的活化与炎症反应和气道重建
上皮损害改变了气道上皮和其下层的间质细胞联系,导致成纤维细胞活化,间质增加,导致气道壁的结构改变。来自Allergy Clin Immunol 2003; 111: 215–25
病理生理改变
在过去的研究中,人们逐渐认识到,气道炎症反应是哮喘的一个重要组成方面。大部分哮喘患者气道有大体的炎性改变和粘液堵塞。死于急性重症哮喘发作的患者,尸检发现:气道的管腔内有血浆蛋白渗出,气管粘膜和粘膜下水肿,细支气管中嗜酸性粒细胞、中性粒细胞、浆细胞渗出。此外,支气管平滑增生肥大,粘膜和粘膜下血管增生,上皮细胞剥脱、及上皮下胶原层增厚。从临床上来看,骤然发作的致死性哮喘可能与支气管粘膜中增多的中性粒细胞有关;这些患者气管干燥,与黏痰堵塞的情况不同,认为是变异性哮喘。对于哮喘急性发作的机制不清楚。但是,细胞活化而产生强力有效的炎症介质,是哮喘病理生理学的核心。在支气管壁和管腔内出现所有炎症细胞几乎都与哮喘粘膜炎症的发生有关。
导致急性重症哮喘发作的原因多种多样,可逆性的气道阻力增加导致气流速度下降,气道过早闭合,肺过度充气,呼吸功增加,肺的弹性回缩力改变。此外,还有通气血流比例失调和动脉血气改变。有梗阻症状和显著过度充气的患者,其心电图表现为肺动脉高压,可有右室损害,低血压和外周组织灌注不良。
呼吸动力学方面出现较大的异常。大量数据表明,进入急性监护病房的患者,其FEV1或者PEFR一般为预计值的40%。临床多见肺内大量的气体陷闭(air tapping),残气量可达正常值的4倍,功能残气量可达期望值的2倍。在大部分发作病人中,总肺活量与预计值基本相同。
在急性哮喘的病理生理学中,过度充气起了十分重要的作用。随着动态过度充气增加,会产生所谓的内源性PEEP(Auto-positive end-expiratory pressure, PEEPi),人们在努力吸气时,必将首先克服PEEPi,才能开始吸入气体。而且此时最终长度-张力曲线会发生改变,收缩力减弱。膈肌的曲率半径会减小,失去其机械学上的优势,最后可能会导致呼吸肌疲劳。由于呼气时胸内压增加,气道狭窄更为明显,加之PEEPi的存在,呼气不再是被动的过程,而是需要呼气肌肉的主动参与才能进行。最后甚至需要动员辅助呼气肌。在急性哮喘中,呼吸肌疲劳的发生率尚不清楚。但在一项研究中没有发现急性发作患者肌肉力量减弱或者疲劳的证据,即使他们的FEV1小于50%预测值。
肺脏容积大而迅速的改变可能与严重的心脏事件相关。静脉回流减少,肺部血管阻力增加。可能由于肺部毛细血管受压、左室前后负荷增加、心排降低所所致。由于气体滞留,胸膜腔负压不稳定,导致吸气时每搏量下降,出现奇脉。
支气管的突然收缩可快速导致呼吸急促,可能是由于活化刺激性受体引起。由于阻塞的分布及程度不均一,导致肺的时间常数有区域性的改变。吸入气体将通过阻力最小的气道进入肺内,使大部分的气体进入了少数的肺泡单元,从而导致通气分布不良。区域性的低氧血症引起肺内血流向通气较好的肺泡单元分布,但这种自身调节功能有限,最终会导致通气-血流比例失调和动脉血气改变。
急性哮喘的典型血气异常为:低氧血症、低碳酸血症和呼吸性碱中毒。一般说,阻塞越严重,动脉氧分压越低。大部分的哮喘发作不伴明显的低氧血症和动脉血氧饱和度降低。仅约8%的患者其PaO2小于50mmHg,而小于40mmHg的患者则更为少见,据报道约有2%。这就是为什么在哮喘急性发作中很少见到紫绀发生的原因。纠正低氧血症是一个缓慢的过程。在一次发作后,由于外周气道的梗阻,通气-血流比例失调会持续几周。
肺泡换气不足可由以下原因造成:外周气道阻塞和大的气道梗阻、使用药物引起呼吸抑制、呼吸肌疲劳或者通气控制机制的异常。患者过度呼吸,PaCO2下降。在急诊患者中,仅有10%的患者出现CO2潴留。当CO2潴留时,FEV1一般会降低到预计值的25%甚至更低。一般来说CO2潴留的程度较轻,多比正常值高出10~15mmHg,有不到7%的患者达到60~70mmHg,极少数患者超过70mmHg(0.4%),除非通气抑制。约有15~20%的患者其CO2水平正常。由于其与FEV1的显著下降有关(小于25%预测值),可以将其视为急性呼吸衰竭,治疗时可以参考。
大部分患者有呼吸性碱中毒。而高碳酸血症可随即发生呼吸性酸中毒。极度的气流受限,可以出现代谢性酸中毒。如心排量降低,外周组织的低氧血症可以导致乳酸性酸中毒的发生和发展。此外,因为呼吸肌做功引起氧耗量的增加也是一种原因。也可因注射非选择性的拟交感类药物引起。
治疗
(一)患者评估和初步处理:哮喘发作时应当尽快处理。和其他类型的重症患者一样,应该首先评估其气道、呼吸和循环(ABCs)。为了保护气道,或者在心功能不佳、休克和意识水平改变时,建议行气管插管术。所有的病人都需要辅助供氧,最好能够面罩给氧。初步评估包括:1)确诊急性哮喘发作;2)简要了解病史,包括症状出现和持续的时间,以及上次加重的病史;3)快速评估精神状态和呼吸窘迫程度(从以下判断:呼吸频率、应用辅助呼吸肌、生命体征、和交感紧张)。应该认识到,急性哮喘患者状态极不稳定,在治疗期间应该动态评估其FEV1和PERF。
(二)药物治疗
拟交感神经药:吸入β2受体激动剂时急性哮喘发作时的一线治疗用药。吸入给药比静脉注射更为有效和安全。定量吸入器(MDI)和雾化吸入同样有效。与雾化吸入器相比,定量吸入器+贮雾装置的优点有:更能够节约费用,起效更快,效率更高,可迅速使支气管扩张达到最大效果。用定量吸入器+贮雾装置吸入沙丁胺醇每次治疗需要2~3分钟,而应用雾化吸入则需要花10~20分钟。逆转哮喘发作所需要吸入β2受体激动剂的剂量与患者症状的严重程度和对激素的反应性有关。一开始,推荐剂量为每15~20分钟吸入4~8次。雾化吸入沙丁胺醇的标准给药方式为每20分钟雾化吸入2.5mg,连续给药3次(即连续吸入1小时)。但是,有研究发现另外一种给药方式,即雾化吸入5mg沙丁胺醇之后,间隔40分钟,再次吸入5mg沙丁胺醇;这种给药方式与标准给药方法相比可以更快的改善肺功能。最近,FDA批准albuterol的R消旋异构体(levalbuterol)作为哮喘的治疗用药。有证据表明所有的支气管扩张剂都是R消旋异构体,而S异构体可以增加气道反应性。Albuterol的S异构体可增加细胞内钙离子浓度,引起平滑肌收缩,诱导气道高反应性,并有促炎症反应效应。由于Albuterol的S异构体的代谢速度较levalbuterol慢10倍,所以S异构体会随着给药频率的增加而积累。临床研究表明,levalbuterol是一种有效的支气管扩张剂,比沙丁胺醇副作用小。由于levalbuterol比沙丁胺醇昂贵,所以这种治疗哮喘的“新型”药物在临床的应用受到一定限制。当吸入给药操作有困难时,可以考虑皮下注射肾上腺素或者静脉注射特布它林,如剧烈咳嗽而难以足量吸入的患者、或濒死病人。尽管医生们很担心该类药物的副作用,但其严重合并症还是不常见的。有学者报道,95%的病人都皮下注射肾上腺素,大部分病人的PEFR有明显改善,而副作用很少。另外有学者发现,在儿童患者给予静脉注射特布它林,可以有血清肌钙蛋白的升高,但是在临床尚未发现显著的心脏毒性。
抗胆碱能类药物:阻断气道平滑肌的M1和M3受体。抗胆碱能药物抑制迷走神经的调节作用,引起支气管扩张。异丙托溴铵是一个四价的抗胆碱药物,其全身吸收量小、副作用少,可以用定量吸入器(MDI)给药。在哮喘加重的患者,异丙托溴铵与β2激动剂联合应用比单独应用β2激动剂效果要好。联合应用尤其适合与有严重气道阻塞的患者。但目前尚缺乏大宗病例随机对照研究证实其疗效。
皮质激素类药物:由于其抗炎作用,在急性和慢性哮喘的治疗中,皮质激素是一类十分重要的药物。但是,尽管皮质激素应用于哮喘治疗已有40余年的历史,依然有很多问题没有解决。系统应用和吸入皮质激素在减少患者哮喘急性发作和慢性哮喘复发方面好处是毫无争议的,但是在急性哮喘发作时,皮质激素的益处尚不太清楚。Rodrigo做的一项meta分析显示:急性哮喘患者发作时在急诊室应用糖皮质激素,既不能改善患者的气流阻塞,也不能减少患者的住院率。作者指出,类固醇之所以不能在急性哮喘早期起作用的原因是,因为皮质激素必须在应用后24小时才能出现明显效果。但是,大量的研究表明,在急诊室应用吸入皮质激素与快速的FEV1改善和低的住院率有关。Rodrigo证实在急诊室给急性哮喘患者吸入高剂量的糖皮质激素3小时即可改善患者肺功能。表明局部应用皮质激素可以导致局部血管收缩而减少水肿形成和血浆渗出。Rowe等证实口服皮质激素加吸入皮质激素可以减少急性哮喘患者急诊后的哮喘复发。数据表明:在急诊室、医院或者出院后,系统应用和吸入皮质激素对急性哮喘加重患者有益(口服泼尼松50mg/天,用7~10天,持续应用吸入激素)。关于哮喘患者在急诊室和住院期间应该系统应用的最佳皮质激素剂量,一直都有争议。由于没有精确的剂量-反应关系,McFadden发现10~15mg/kg/24h氢化可的松,或者等量的其它皮质激素,对于急性哮喘患者是最有效的。换算为甲基泼尼松龙每天120~180mg。这个剂量为NAEPP专家会议和加拿大成人哮喘急诊处理指南(CAEP/CTS Asthma Advisory Committee)所推荐剂量。对于急性哮喘发作的GINA2006推荐剂量为:等剂量的泼尼松40~60mg每日1次或者分2次用。尽管有这个建议,最常用的剂量是每6小时60~125mg甲基泼尼松龙。
甲基黄嘌呤类:甲基黄嘌呤广泛应用于支气管痉挛的治疗至少50年了。但是,在过去的几年里对该类药物的作用不太清楚,尤其对其和β2受体激动合用时所产生的额外益处。三个meta分析通过安慰剂对照,评价了氨茶碱在和β2受体激动合用治疗成人急性哮喘的作用。它们都不能证实这种联合有明显的好处,因此没有足够的证据做决定性的推荐。值得提出的是meta分析纳入的大部分临床研究都不是高质量的、随机对照试验。因此其有效性尚需进一步研究。
白三烯调节药:白三烯诱导的病理生理反应与哮喘的病理生理反应相似,有广泛的证据表明这种细胞因子在哮喘的病理生理中有重要作用。目前出现的白三烯调节剂包括白三烯受体拮抗剂和白三烯合成酶抑制剂。白三烯调节剂的重要性在于:仅仅靠糖皮质激素并不能抑制白三烯的生成和在气道中的释放。矛盾的是,5脂氧化酶活化蛋白(FLAP)基因启动子包括糖皮质激素反应元件,已经证实糖皮质激素可以增强FLAP的合成,增加5脂肪氧化酶产物的释放。这个证据表明白三烯调节药和皮质激素合用对于哮喘患者有互补的抗炎作用。事实上,吸入性皮质激素联合白三烯调节剂已被证实能改善对慢性哮喘的控制。目前,5脂氧化酶抑制剂(齐留通)和白三烯受体拮抗剂(扎鲁斯特和孟鲁斯特),已经被美国批准用作治疗慢性哮喘。一个已经完成的关于急性哮喘发作急诊患者的多中心、随机、安慰剂对照试验证实:加用高剂量扎鲁斯特可以使住院率降低34%,随访发现,复发率可以减少18%。这个试验表明白三烯调节剂对于急性哮喘也有一定疗效。尚需要进一步研究,探索该类药物治疗急性哮喘的适应症和具体剂量。但是,对于那些对常规治疗反应差的哮喘患者,在治疗方案中加用白三烯调节剂似乎是合理的。
抗生素:如果没有肺炎或者其他细菌性感染的证据,对于急性哮喘加重的患者常规不推荐抗生素治疗。脓痰也许不是感染指症,多是由于呼吸道分泌物中过多的嗜酸性粒细胞所形成。痰液中嗜酸性粒细胞的浓度与气道炎症反应的严重程度相关。
水合作用:有证据表明,急性哮喘加重期的患者多处于脱水状态。但是,没有证据表明,液体可以改变哮喘患者痰液的粘性或者促进痰液排出。只有有临床脱水征象的患者,才应该给予补液治疗。
(三)再次评估和处置
在急诊室患者对于治疗的反应决定后续的治疗计划。应用β2受体激动剂,抗胆碱能药物和皮质激素治疗1~3小时后,应该再次评估患者状况。
在此期间,那些FEV1或者PEFR大于70%预测值的患者,需要继续观察1小时,确保得到稳定的改善。这些病人大部分不需要住院治疗。但是,高危险因素的患者,如那些有气管插管和机械通气史或者依从性差的患者,以住院治疗为宜。从急诊室出院的患者,应该继续应用吸入和口服皮质激素及吸入β2受体激动剂,交代用药方法,制定症状控制计划,特别说明药物随访。虽然没有证据表明基于急诊室的教育有益于患者的症状控制,但国家哮喘教育和预防计划(NAEPP)对于哮喘患者治疗包括在急诊室的治疗是重要。
那些FEV1或者PEFR改善在50%到70%预测值之间的患者,对于治疗反应不完全,需要仔细分类。一些患者确实症状缓解,在详细的交代和密切的医疗随访下可以出院。但是,高危患者包括那些有:1)气管插管和机械通气史的患者;2)因哮喘而有急诊就诊史和住院史的患者;3)加重持续大于1周;4)目前应用皮质激素治疗,和5)家中无良好的控制条件或者依从性差的患者应该住院治疗。
在4个小时的加强治疗后,FEV1和PEFR依然小于50%预测值的患者,需要住院治疗。
收入ICU的值征:在急诊室加强治疗4小时的急性哮喘加重患者有下列情况时应该收入ICU:1)因呼吸急促而语言困难;2)意识障碍;3)不能平躺;4)FEV1或者PEFR小于25%预测值;5)吸入40%氧气的情况下,PaO2小于65mmHg;6)PaCO2大于40mmHg,和6)疲劳患者。
(四)无创正压通气(NPPV)
严重哮喘患者其吸气和呼气时的气道阻力和肺动态顺应性显著增加(过度充气)。FEV1下降至基线的50%,吸气肌做功增加7~10倍。由于气道阻塞变得更加严重(FEV1小于预测值的25%),呼吸功过度增加,导致吸气肌疲劳和通气衰竭。此时,需要辅助通气。气管内插管有较高的合并症发生率,并且会引起气道阻力增加。在有急性呼吸衰竭的COPD患者,无创正压通气(NPPV)在减少呼吸功,改善氧合,减少插管率等方面有很好作用。理论上,NPPV的出现,为难治性哮喘提供了一个很好的治疗方法。在重型哮喘患者,面罩持续气道正压(CPAP)可以抵消内源性呼气末末正压(PEEPi),扩张支气管,降低气道阻力,减少呼吸功,使肺得以复张,并能促进分泌物排除,也可使膈肌和吸气肌得到休息,降低有害的血流动力学效应(改善胸膜腔压力)。
NPPV的优点有:改善患者状况,减少镇静剂用量,避免气管内插管及由其引起的合并症(包括上呼吸道创伤,鼻窦炎,耳炎,和医院获得性肺炎)。此外,对气道保护机制,语言和吞咽没有任何影响,患者一直处于清醒状态有利医患交流。Meduri等证实NPPV能够安全地用于那些经积极药物治疗无效的严重哮喘和高碳酸血症患者。对于清醒合作的患者,在行气管插管前应该首先考虑NPPV。高血压患者、心肌缺血、严重心室率失常、难以保护气道的患者、或者严重低氧血症患者(SaO2小于90%或者面罩吸氧下PaO2小于60mmHg)应该避免NPPV。
BiPAP允许对呼气末气道正压和吸气末气道正压进行独立控制。这种通气模式可以通过一种敏感的触发装置增强自主呼吸,可以通过增大气流量以补偿因各种原因导致的漏气(如面罩与面部不贴合、鼻罩引起的口腔漏气)。
据Meduri等报道,以常规呼吸机通过面罩在压力支持通气(PSV)模式下进行NPPV时,初始设置CPAP为0cmH2O,PSV为10cmH2O;然后将CPAP增加到3~5cmH2O,PSV增加到能使呼出潮气量增加大于7ms/kg,呼吸频率小于25次/分钟。通过4小时的持续NPPV后,患者可以摘掉面罩在吸氧状态下休息(15分钟),同时可以喝水和进食。在通气的同时可以雾化吸入支气管扩张剂。
(五)气管内插管
气管内插管预示着难以治愈和高的死亡率。因急性重症哮喘而急诊的患者仅有一小部分需要气管内插管和辅助通气。不可轻率的决定对哮喘患者行气管内插管。气管插管的时机需要斟酌决定。急性哮喘导致的高碳酸血症(PaCO2大于40mmHg)是很麻烦的,这些患者们需要个体化的评估而且大部分需要气管内插管。如果患者意识清醒且合作的话,高的PaCO2本身不是气管插管的值征。Bondi和Williams报道了27例合并高碳酸血症的哮喘患者;有23例确实不需要插管。同样的,Mountain和Sahn报道的61例急性重症哮喘患者合并高碳酸血症者中仅有5例需要插管。
气管内插管和机械通气的指征为:
1)意识水平降低;
2)非重复呼吸面罩(nonrebreathing mask)下吸氧PaO2小于50mmHg;
3)PaCO2上升导致pH下降;
4)临床过程快速恶化的过敏性哮喘;
5)患者疲劳,和6)NPPV不能凑效的患者。
对哮喘患者插管是十分困难的,由经验丰富的医生行经鼻插管是比较安全的。这种方法可以使患者保持直立位,不用麻醉药,对气道基本不造成影响。但经鼻插管限制了管腔直径,损伤上呼吸道,导致鼻出血的合并症。此外,经鼻插管可以使同时存在的鼻窦疾病恶化。另外有可能引起喉痉挛和支气管收缩反射。
经口腔插管,应用镇静剂,在一些特定的患者(除了濒死病人)和可以自主控制气道的患者都会成功。快速诱导镇静,在紧急状况下推荐使用,因为它可以最大限度的帮助插管成功。
常用的镇静剂:由于地西泮起效慢,而且经常不能达到最佳的肌松效果,所以不推荐使用。
氯胺酮,具有镇静,镇痛,麻醉和支气管扩张特性的一种静脉用全身麻醉药,广泛用于需要插管的急诊哮喘病人。常用剂量为1~2mg/kg,可提供10~15分钟的全身麻醉,但不会引起明显呼吸抑制。氯胺酮可以增加喉反射,所以尽量避免过度刺激上呼吸道,减少喉痉挛的发生。
异丙酚是一种短效的静脉用镇静剂,可以减少需要机械通气的支气管痉挛患者的气道阻力。是气管插管的良好诱导剂,对机械通气患者起镇静作用。推荐诱导剂量为2~2.5mg/kg,随后应用50~100ug/kg/min静滴维持以达到维持机械通气的镇静效果。可以导致低血压,尤其是在血容量不足的患者,应引起注意。
依托咪酯(0.2~0.4mg/kg)是一种速效催眠剂,对血流动力学影响效。依托咪酯不会导致显著的支气管扩张作用,不会引起组织胺释放。对于血流动力学不稳定的患者,它是异丙酚的替代药品。
氯化琥珀胆碱是快速诱导的肌肉麻痹剂。它可以释放组织胺,但是在临床实践中这种作用似乎不很显著。
罗库溴铵是一种短效的非去极化肌松剂,无显著的血流动力学效应,是氯化琥珀胆碱的替代用药。罗库溴铵0.9~1.2mg/kg。
(六)辅助机械通气
在插管的哮喘患者,完成呼吸是十分困难的。当给插管患者捏皮球时(在机械通气机连接好之前),应该特别注意防止过度通气。严重哮喘患者的机械通气是十分困难的。严重的气流阻塞导致呼气时间延长,即使在较低的通气频率下也会呼气不完全。这就导致了渐进性的动态过度充气,促使形成PEEPi,直到功能残气量在某个容量达到一个新的平衡。达到新的平衡是由于肺容积的扩大从而使驱动呼气的肺弹性回缩压增加,并且随着肺容积的扩大使小的气道扩张从而减少气道阻力。但是,如果患者以“常规”潮气量(12mL/kg)和频率(12~16/min)进行通气,严重的动态过度充气就会产生更高水平的PEEPi。PEEPi可减少静脉回心血量,导致严重的血流动力学失常。此外, PEEPi起到了吸气阈值负荷(需要负压增加到一定程度才能触发通气)的作用,显著增加呼吸功。由于上述改变,试图达到正常血二氧化碳的通气策略将会导致发病率和死亡率的升高。对于哮喘患者应用PEEP模式是有争议的。严重的COPD患者和急性呼衰患者,PEEP可以减少呼吸功,缓解呼吸困难。由于小气道的气流受限,低水平的压力不会导致肺泡内压力的升高。设置低于PEEPi的PEEP水平,也许会使狭窄或者塌陷的气道扩张,使相应的肺泡单元能够复张。另外,会使呼气末肺泡压力(total PEEP)和中央气道的压力梯度减小。这样就可以降低触发通气的阈值。但是,过高的PEEP可以导致肺容积和肺泡压力增大,引起回心血量的减少和低血压。判断哪些患者可能适合PEEP的一个实用的方法就是:观察呼吸机周期性压力(ventilator cycling pressures)对PEEP轻度增加的反应。如果增加PEEP后,呼吸机动态和静态峰循环压力基本不改变,说明肺部没有广泛的气道塌陷,此时应用PEEP效果较好。PEEP水平设置不应该高于内源性PEEP水平。另一方面,如果呼吸机循环压力随着PEEP水平改变,则可能发生了过度充气。使严重哮喘患者充分氧合并不是件难事,难的是使其达到完全的肺泡通气。
通气治疗的目标为:
1)保持气道峰压小于50cmH2O;
2)保持动脉血pH大于7.2;
3)限制PEEPi在5~10cmH2O。推荐的通气模式是同步间歇性指令通气(SIMV)模式可以不加或加用较低压力支持。一般不用辅助控制通气模式。因为这易使患者产生过高的分钟通气量和PEEPi。对于吸气流速的设置依然是有争议的,有的推荐高的吸气流速,有的则相反。更多的证据支持高的吸气流速。但是,对于有严重气道阻塞的患者,需要延长吸气时间;高的吸气流速会导致吸气压力过高。推荐的初始通气设置如下:
1)FiO2 100%;
2)呼吸频率8~14次/ 分钟,根据气道阻塞程度而定;
3)峰流速80~100L/min;
4)潮气量为6~8ml/kg。
所有的患者都要测定其PEEPi水平和呼气潮气量,防止气体滞留。通常应用较低的吸呼比(呼气时间较长)。在插管后依然有严重气道阻塞的患者允许通气不足;但动脉血的pH应该保持在7.20以上。尽量避免应用碳酸氢钠,因其可以提高细胞内二氧化碳含量,引起细胞内酸中毒,出现更糟糕的结果。
(七)其它治疗方法
有报导使用硫酸镁、升血糖素、硝酸甘油、钙通道阻断剂、氯压定或吸入利尿剂、肝素等方法治疗重症哮喘,但没有随机病例对照研究所证实。在接受了强有力的常规平喘药治疗的病人中,上述治疗似乎不能显示其支气管扩张效应。由于它们中的大部分药物具有明显的副作用,因此没有得到推荐。
全身麻醉药:多种全身麻醉药,无论吸入还是静脉用药,已经用于顽固性哮喘患者的救治,对极其严重的患者,或许是挽救生命的一种治疗措施。吸入性麻醉剂——异氟醚具有良好的支气管扩张效应和极小的致心律失常副作用,因此最适合于哮喘的救治。Maltais及其同事在对3例以强有力的常规平喘治疗不得改善的患者吸入异氟醚,证实其动态过度充气和PEEPi降低。氯胺酮静脉注射通过促进内源性儿茶酚胺的释放而发挥其支气管扩张作用。静脉再给予氯胺酮2mg/kg,持续给予氯胺酮20~60ug/kg/min维持麻醉。由于缺乏随机对照研究,其有效性尚需证实。
氦:氦——氧混合气密度是空气的三分之一,可降低气道阻力,增加最大的呼气流速。以此种气体治疗哮喘还存在争议。但这种混合气体能降低机械通气患者的吸气峰压和PaCO2,改善氧合。因此有人认为可以在机械通气的患者中尝试这一方法。
体外膜式氧合:用于机械通气治疗不能取得适当氧合的严重顽固性哮喘患者,使其有足够的时间让药物发挥作用,度过危险期可能是有益的。