白三烯受体拮抗剂在支气管哮喘治疗中的应用
2016/07/07
南京医科大学第一附属医院(江苏省人民医院) 225700
一、LTs的合成
白三烯(LTs)是花生四烯酸(AA)经5-脂氧合酶(5-Lox)途径产生代谢产生的一组炎性介质。细胞膜和核膜的脂质的双分子层在磷脂酶A2的作用下产生花生四烯酸(AA)。花生四烯酸(AA)在5-Lox和5-脂氧酶激活蛋白(FLAP)催化下生成不稳定的中间体5-过氧羟-二十碳四烯酸(5-HPETE),随后,在脱水酶的催化下进一步形成不稳定的环化物白三烯A4(LTA4),LTA4形成后分两条路线代谢,一条路线是通过LTC4合成酶(LTC4-S)进一步代谢合成LTC4(LTC4)。LTC4被特异性的跨膜转移蛋白转移到细胞外,再被谷氨酰转肽酶和半胱氨酸甘氨酸二肽酶分别代谢为LTD4(LTD4)及LTE4(LTE4);另一条路线是被LTA4水解酶水解为LTB4。由于LTC4、LTD4和LTE4均含有半胱氨酸酰残基,故统称为半胱氨酸酰白三烯(CysLTs)。多种细胞包括嗜酸性粒细胞、中性粒细胞、肥大细胞、淋巴细胞、单核细胞和巨噬细胞等,都参与了CysLTs 的合成过程。但是各种细胞合成LTs的方式、数量和种类不尽相同。
二、LTs在哮喘发病中的作用
1. LTB4
LTB4主要是由中性粒细胞产生,它是一种局部作用的炎性介质,对气道无收缩作用,可趋化中性粒细胞,对嗜酸性粒细胞具有轻微的趋化作用。体内研究表明LTB4能促使白细胞由血管进入组织间隙。接触LTB4后,多核白细胞迅速聚集,稍后便出现嗜酸性粒细胞的聚集。LTB4还可以刺激超氧阴离子分泌及白细胞释放其颗粒成分,并影响B淋巴细胞低亲和力IgE受体的表达[3]。目前对于LTB4在哮喘中的作用尚不明确。
2. CysLTs(LTC4、LTD4、LTE4)
目前认为CysLTs是哮喘发病机制中最重要的炎性介质之一,由嗜酸性粒细胞、肥大细胞等炎性细胞合成与释放。它对人体支气管平滑肌的收缩作用较组胺以及血小板活化因子(PAF)强约1000倍。CysLTs是中性粒细胞的强趋化剂与激活剂,可吸引嗜酸性粒细胞和中性粒细胞向肺内迁移聚集,增加中性粒细胞黏附到血管内皮、脱颗粒和释放溶酶体酶,从而促进炎症细胞的浸润,在哮喘的气道炎症反应过程中起着重要作用。CysLTs受体根据对经典的CysLTs拮抗剂的敏感性不同,可分为CysLT1R和CysLT2R。对激素敏感的受体定义为CysLT1R,对激素不敏感的受体定义为CysLT2R。人的气道平滑肌仅存在CysLT1R,CysLT1R为完全激动剂,CysLTs参与哮喘发病过程主要由CysLT1R介导[4]。LTs与其受体结合,还可引起支气管平滑肌的收缩[5],刺激黏液的分泌,增加血管通透性,促进黏膜水肿形成,使炎性细胞的活性发生改变,致使气道反应性增高。同时LTs与其受体结合,还可通过磷脂酶C途径激活肌醇脂质信使系统从而促进气道结构细胞,如气道上皮细胞、成纤维细胞和血管平滑肌细胞等的增殖,从而促进气道重塑[6]。Panettireri等[7]对LTD4的研究却发现单独的LTD4对人类平滑肌细胞的DNA合成不起作用,但它可明显加强由表皮生长因子诱导的平滑肌增生。近年研究表明LTs能促进内皮素-1的释放,而内皮素-1(ET-1)是迄今所知最强大的支气管平滑肌收缩剂,因此其作用机制可能是通过直接或间接调节其他因子的释放发挥作用。
三、LTRA在哮喘中的应用
1. LTRA的作用机制
LTRA与支气管平滑肌等部位上CysLT1R选择性结合,竞争性拮抗CysLTs,进而阻断对LTs的效应。主要包括:
(1)抑制多种炎症介质和细胞因子的释放,发挥抗炎作用:过敏性哮喘是以嗜酸性粒细胞(EOS)和T细胞等浸润为特征的气道慢性炎症疾病。发病时活化的EOS脱颗粒,释放多种生物活性蛋白如嗜酸性粒细胞趋化因子(Eotaxin)、IL-5、IL-13、血管内皮细胞黏附因子-1(VCAM-1)和嗜酸性粒细胞阳离子蛋白(ECP)等。Eotaxin对EOS具有特异性的趋化作用,在哮喘发病过程中能够选择性诱导和趋化EOS在肺组织中募集,其表达强度与支气管壁EOS数量及哮喘的严重程度呈显著正相关[8]。多项研究[8-10]表明IL-4、IL-5和IL-13共同调控EOS的发育与激活。VCAM-1是调节EOS从外周血迁移到血管外及肺泡间隙里的最重要的黏附因子。研究表明,LTRA如孟鲁司特对多种炎症介质及细胞因子均有不同程度的抑制作用,能降低哮喘动物肺组织中IL-5、IL-13、VCAM-1、内皮素-1(ET-1)和干扰素(INF-γ)的水平[11]。LTRA可以通过抑制上述炎症介质及细胞因子的释放,预防及减轻炎症细胞的浸润,从而抑制气道炎症。
(2)舒张支气管平滑肌:LTs可通过直接和间接的途径引起支气管平滑肌收缩。LTRA与其受体结合,竞争性抑制了LTs与受体的结合,从而舒张支气管平滑肌和改善肺通气功能,提高哮喘患者的生活质量。
(3)降低气道高反应性,改善肺功能:研究表明,70-80%的哮喘患者存在由体力活动诱发的气道收缩,即运动性哮喘(EIA)[12]。患者运动后存在AHR,并且尿中LTs代谢产物LTE4水平升高,提示LTs参与了EIA的发病。一项长期研究显示孟鲁司特对运动导致肺功能下降起到有效且持久的保护作用,且无反跳现象[13]。
(4)抑制气道重塑:目前认为,哮喘发病早期即存在气道重塑。气道炎症和气道重塑同时发生,且气道重塑存在于哮喘病程中的各个阶段。气道重塑可使哮喘患者的肺功能快速下降,严重影响了患者的生存质量,甚至发展为重症哮喘或哮喘-慢性阻塞性肺疾病重叠综合征(ACOS),因此早期抗气道重塑尤为重要。目前尚无专门针对气道重塑的药物,但部分哮喘治疗药物如LTRA也对哮喘气道重塑有效[14]。细胞周期蛋白D1(CyclinD1)是哺乳动物真核周期进程中重要的正性调节蛋白,支气管平滑肌细胞的分裂增殖与之密切相关,能加速气道重塑的进程。白三烯受体拮抗剂可通过抑制CyclinD1表达从而延缓气道重塑[15]。基质金属蛋白酶(MMPs)能降低细胞外基质(ECM),与气道炎症及气道重塑关系密切。其中基质金属蛋白酶-9(MMP-9)是降解ECM的主要蛋白,在抗原暴露后的气道炎症中起关键作用[16]。LTRA能够减少分泌MMP-9炎性细胞的数量,从而间接降低MMP-9的表达来减少气道重塑的发生。
(5)诱导细胞凋亡:研究显示,LTRA可促进细胞凋亡。Melis等研究显示,从健康对照组及哮喘患者组外周血中分离出淋巴细胞,加入培养基培养,发现哮喘患者淋巴细胞凋亡的速度明显落后于健康对照组;加入扎鲁司特后健康组的淋巴细胞不受影响,而哮喘组淋巴细胞凋亡的速度明显加快。
2. 常见的LTRA
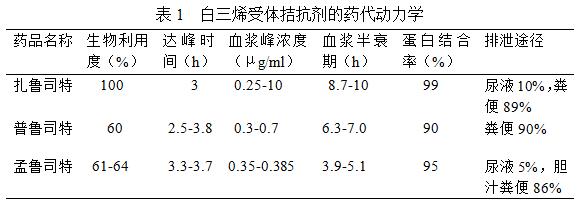
目前临床常见的LTRA是孟鲁司特,其他还包括扎鲁司特和普鲁司特,其药代动力学见表1[17]。
3. LTRA在哮喘中的合理应用
(1)轻-中度哮喘的替代治疗:2016年的“哮喘防治创议”(GINA)的“5级阶梯治疗”中,第2级治疗是可根据具体情况选用低剂量吸入型糖皮质激素(ICS)或者白三烯受体调节剂(包括LTRA和5-Lox 抑制剂)[18]。ICS是哮喘治疗的一线药物,是控制气道炎症最有效的药物。但是对于未掌握吸入技术或者对吸入剂依从性较差以及由于担心激素副作用而不愿意接受激素治疗的轻中度哮喘患者,可以使用白三烯受体拮抗剂替代治疗。另外,少数对激素治疗效果不好或者出现ICS不良反应的哮喘患者可加用或换用LTRA。对于GINA中的第3级治疗,由于长期大量使用激素可能会引起骨质疏松等不良反应,联合使用LTRA可降低激素使用的剂量,减少激素的不良反应。
(2)中-重度哮喘中也可减少激素用量,起到协同作用:GINA中的第4、5级治疗方案均推荐应用LTRA,并且是A类的循证医学证据[18]。
(3)阿司匹林哮喘(AIA):AIA大多由阿司匹林或者其他的非甾体抗炎药(NSAID)诱发,大多数患者表现为ICS依赖的难治性哮喘,且病死率较高。AIA的发生主要是由于AA代谢过程中的环氧化酶受抑制,导致前列腺素合成受阻,LTs合成增加,引起支气管平滑肌收缩。大量研究证明LTRA不仅可以改善AIA患者的临床症状,而且降低AHR和提高其对NSAID的耐受性。
(4)运动性哮喘(EIA):EIA是由运动诱发支气管痉挛而发生的哮喘发作。较多研究表明EIA患者运动后尿中LTs升高,表明LTs在EIA的发病中有重要作用。LTRA不仅可以减少运动导致的肺功能下降,而且可以缩短肺功能恢复至正常的时间,并减少β-2受体激动剂的使用数量。
(5)合并变应性鼻炎的哮喘:流行病学研究表明,哮喘患者中有60-70%合并变应性鼻炎,是正常人群的5-7倍,是正常儿童的8倍,而变应性鼻炎患者中有20-38%合并哮喘。变应性鼻炎是哮喘的重要危险因素[19]。因此对于合并变应性鼻炎的哮喘患者,治疗哮喘的同时也要治疗过敏性鼻炎。大量的临床研究表明鼻内ICS对哮喘引起的呼吸道症状及气道高反应性影响较小,气管内ICS对鼻内症状无改善,而LTRA可同时改善变应性鼻炎和哮喘的症状[20],因此对于合并变应性鼻炎的哮喘患者可单用LTRA或者在ICS的基础上加用LTRA,既可同时治疗过敏性鼻炎和哮喘,又可以避免气道和鼻内同时使用ICS引起激素过量带来的不良反应。
(6)激素抵抗型哮喘:部分哮喘患者对大剂量激素治疗临床反应差,且外周血嗜酸性粒细胞计数在激素治疗后下降程度显著低于其他哮喘,即激素抵抗型哮喘。目前激素抵抗型哮喘的机制尚不清楚,有学者认为哮喘气道炎症的产生有两种途径:一条是激素敏感性介质介导的,糖皮质激素主要通过此条途径抑制气道炎症;第二条是非激素敏感性介质介导的,其中最为重要的是LTs,而激素对LTs的抑制作用不明显。由于激素和LTRA作用机制的差异,因此可选用LTRA治疗激素抵抗型哮喘,也需要更多的基础及临床研究以进一步证实。
四、LTRA的安全性与局限性
文献报道LTRA副作用主要有食欲不振、头痛、肝功能受损和白细胞下降等,其中孟鲁司特副作用较轻且不影响治疗。孟鲁司特作为FDA唯一批准上市的LTRA药物,其安全等级为B级,对孕妇及儿童哮喘患者较为安全。在治疗急性哮喘上,LTRA的疗效尚未确定。因此LTRA尚不推荐用于哮喘急性发作的治疗,也不宜突然代替激素。体外实验证明高浓度的扎鲁司特可抑制肝脏细胞色素P450 2C9异构酶系统,竞争性抑制氨茶碱的分解,使氨茶碱的血药浓度提升。因此在与氨茶碱合用时,必须监测氨茶碱的血药浓度。
五、总结和展望
LTRA能有效减轻轻/中/重度哮喘患者的临床症状,改善肺功能,提高生活质量,安全性高,不良反应较少,且服用方便。ICS联用LTRA可明显减少ICS剂用量,在临床上逐渐显示其独特的治疗价值,尤其在某些特殊类型哮喘治疗中价值更为显著。由于LTRA与激素的作用机制不同,因此加用LTRA可以对哮喘患者带来更好的疗效,其对哮喘气道重塑的作用也日益受到关注。
参考文献
1.Murdoch JR, Lloyd CM. Chronic inflammation and asthma[J]. Mutat Res. 2010, 690(1-2): 24-39.
2.Nicosia S, Capra V, Rovati G E. Leukotrienes as mediators of asthma.[J]. Pulm Pharmacol Ther, 2001, 14(1):3-19.
3.Odlander B, Jakobsson P J, Rosèn A, et al. Human B and T lymphocytes convert leukotriene A 4, into leukotriene B 4[J]. Biochem Biophys Res Commun, 1988, 153(1):203-208.
4.Capra V. Molecular and functional aspects of human cysteinyl leukotriene receptors[J]. Pharmacol Res, 2004, 50(1):1-11.
5.Holroyde M C, Altounyan R E, Cole M, et al. Selective inhibition of bronchoconstriction induced by leukotrienes C and D in man.[J]. Adv Prostaglandin Thromboxane Leukot Res, 1982, 9:237-242.
6.Dent G, Rühlmann E, Bodtke K, et al. Up-regulation of human eosinophil leukotriene C 4, generation through contact with bronchial epithelial cells[J]. Inflamm Res, 2000, 49(5):236-239.
7.Panettieri R A, Tan E M L, Ciocca V, et al. Effects of LTD4 on Human Airway Smooth Muscle Cell Proliferation, Matrix Expression, and Contraction In Vitro: Differential Sensitivity to, Cysteinyl Leukotriene Receptor Antagonists[J]. Am J Respir Cell Mol Biol, 1998, 19(3):453-61.
8.Humbles A A, Conroy D M, Marleau S, et al. Kinetics of eotaxin generation and its relationship to eosinophil accumulation in allergic airways disease: analysis in a guinea pig model in vivo.[J]. J Exp Med, 1997, 186(4):601-12.
9.Stelmach I, Jerzynska J, Kuna P. A randomized, double-blind trial of the effect of treatment with montelukast on bronchial hyperresponsiveness and serum eosinophilic cationic protein (ECP), soluble interleukin 2 receptor (sIL-2R), IL-4, and soluble intercellular adhesion molecule 1 (sICAM[J]. J Allergy Clin Immunol, 2002, 109(2):257–263.
10.Wu A Y, Chik S C, Chan A W, et al. Anti-inflammatory effects of high-dose montelukast in an animal model of acute asthma[J]. Clin Exp Allergy, 2003, 33(3):359–366.
11.Finsnes F, Lyberg T, Christensen G, et al. Leukotriene antagonism reduces the generation of endothelin-1 and interferon-gamma and inhibits eosinophilic airway inflammation[J]. Respir Med. 2002, 96(11):901-906.
12.郭岩斐, 孙铁英. 运动性哮喘[J]. 中华结核和呼吸杂志, 2000, 23(6):373-375.
13.孙铁英, 郭岩斐, 许小毛,等. 孟鲁司特钠治疗运动诱发性支气管收缩的临床研究[J]. 中华结核和呼吸杂志, 2005, 28(2):83-87.
14.Berair R, Brightling CE. Asthma therapy and its effect on airway remodelling[J]. Drugs, 2014, 74(12):1345-1369.
15.葛海燕, 黄茂, 姚欣, 等. 白三烯受体拮抗剂对哮喘小鼠气道重塑及细胞周期蛋白D1的表达影响[J]. 南京医科大学学报(自然科学版), 2006, 26(4):257-261.
16.Cataldo DD, Tournoy KG, Vermaelen K, et al. Matrix metalloproteinase-9 deficiency impairs cellular infiltration and bronchial hyperresponsiveness during allergen-induced airway inflammation[J]. Am J Pathol, 2002, 161(2):491-498.
17.马永录, 蒋坤, 任耘. 白三烯受体拮抗剂治疗哮喘的进展和临床评价[J]. 中国医院用药评价与分析, 2004, 4(5):273-276.
18.Global Strategy for Asthma Management and Prevention(2015 update)[J]. Global Initiative for Asthma(GINA). Available at: http://www.ginasthma.org.
19.蒋雄斌, 殷凯生. 鼻部疾病对哮喘控制的影响. 中华医学杂志, 2009, 89(8): 510-511.
20.Philip G, Nayak A S, Berger W E, et al. The effect of montelukast on rhinitis symptoms in patients with asthma and seasonal allergic rhinitis.[J]. Curr Med Res Opin, 2004, 20(10):1549-
上一篇:
哮喘管理和预防———哮喘教育
下一篇:
雌激素信号通路调节过敏反应在哮喘性别差异中的意义









